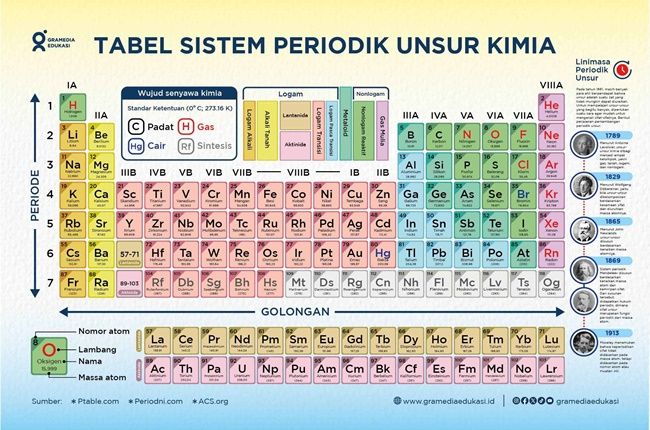
perkembangan sistem periodik unsur – Grameds, pernahkah kamu bertanya-tanya bagaimana para ilmuwan dulu menyusun ratusan unsur yang kini kita pelajari di pelajaran kimia? Sistem periodik unsur yang kita kenal sekarang bukanlah hasil kerja satu malam, melainkan rangkaian panjang penemuan, eksperimen, dan pembaruan yang terus berkembang dari abad ke abad.
Dari sekadar mengelompokkan unsur berdasarkan massa, hingga akhirnya disusun rapi berdasarkan nomor atom, sistem ini menjadi salah satu pencapaian paling penting dalam dunia sains. Nah, di artikel ini, kita akan menelusuri perjalanan menarik bagaimana sistem periodik unsur berkembang hingga seperti yang kita lihat di ruang-ruang kelas saat ini. Yuk, kita mulai perjalanan ilmiahnya!
Daftar Isi
Sejarah Perkembangan Sistem Periodik Unsur

Sumber: Pexels
Berikut ini adalah penjelasan mengenai perkembangan sistem periodik unsur, diantaranya adalah:
1. Pengelompokan Unsur oleh Antoine Lavoisier (1789)
Antoine Lavoisier merupakan Ilmuwan asal Prancis yang menjadi tokoh awal dalam usaha sistematisasi unsur. Ia mengklasifikasikan zat-zat kimia yang dikenal saat itu ke dalam kelompok seperti logam, nonlogam, gas, dan tanah. Meskipun belum sepenuhnya akurat (karena masih mencampurkan unsur dan senyawa), upaya ini menjadi langkah awal dalam pengelompokan unsur berdasarkan kemiripan sifat. Ia juga menekankan pentingnya hukum kekekalan massa dalam reaksi kimia, yang memperkuat fondasi bagi ilmu kimia modern.
2. Triade Dobereiner (1817)
Johann Wolfgang Döbereiner yang berasal dari Jerman, memperkenalkan konsep triade, yaitu pengelompokan unsur-unsur dalam tiga serangkai berdasarkan kemiripan sifat dan massa atom. Contohnya, klorin, brom, dan iodin: unsur tengah (brom) memiliki massa atom mendekati rata-rata dari dua lainnya. Meskipun terbatas hanya pada beberapa unsur, ide Dobereiner menunjukkan bahwa unsur-unsur memiliki keteraturan sifat tertentu yang bisa diprediksi.
3. Hukum Oktaf Newlands (1864)
Seorang ilmuwan Inggris bernama John Newlands, mencoba menyusun unsur berdasarkan kenaikan massa atom relatif dan menemukan bahwa setiap delapan unsur menunjukkan pola sifat yang mirip seperti oktaf dalam musik. Maka dari itu, ia menyebutnya “Hukum Oktaf.” Meski idenya cukup berani, pada saat itu ia menerima banyak kritik karena memaksakan unsur yang belum memiliki kemiripan jelas ke dalam pola tersebut. Namun, ini tetap menjadi kontribusi penting dalam pencarian keteraturan kimia.
4. Sistem Periodik Mendeleev (1869)
Dmitri Mendeleev dari Rusia menjadi tokoh sentral dalam sejarah sistem periodik. Ia menyusun unsur berdasarkan kenaikan massa atom, tetapi juga mempertimbangkan kemiripan sifat kimia dan fisika. Keistimewaan sistem Mendeleev adalah kemampuannya meninggalkan ruang kosong untuk unsur yang belum ditemukan, serta memprediksi sifat unsur tersebut secara akurat, seperti germanium dan gallium. Namun, karena beberapa unsur tidak sesuai urutan massa atom, sistem ini mulai menunjukkan kelemahan.
5. Penemuan Nomor Atom oleh Henry Moseley (1913)
Perubahan besar datang saat Henry Moseley, ilmuwan Inggris, menemukan bahwa sifat-sifat unsur lebih sesuai bila diurutkan berdasarkan nomor atom (jumlah proton), bukan massa atom. Ia menggunakan teknik spektroskopi sinar-X untuk menentukan nomor atom secara eksperimental. Penemuan ini menyelesaikan beberapa anomali dalam sistem Mendeleev, seperti letak argon dan kalium. Inilah titik awal sistem periodik modern seperti yang kita kenal sekarang.
6. Sistem Periodik Modern (Setelah 1913 – Sekarang)
Setelah Moseley, sistem periodik terus disempurnakan. Unsur-unsur disusun berdasarkan kenaikan nomor atom dan konfigurasi elektron, membentuk tabel periodik panjang (long form periodic table). Unsur-unsur dikelompokkan ke dalam blok (s, p, d, f), golongan (vertikal), dan periode (horizontal). Perkembangan ini juga memungkinkan penambahan unsur transuranium (unsur buatan yang lebih berat dari uranium), serta revisi nama dan simbol unsur oleh IUPAC.
7. Penambahan Unsur Baru dan Revisi oleh IUPAC (2000-an ke atas)
Di era modern, penemuan unsur-unsur superberat seperti ununpentium (115), livermorium (116), tennessine (117), dan oganesson (118) menandai batas sementara sistem periodik saat ini. Organisasi IUPAC (International Union of Pure and Applied Chemistry) mengesahkan nama-nama unsur baru, dan terus merevisi sistem sesuai perkembangan ilmu pengetahuan dan teknologi nuklir. Tantangan selanjutnya adalah menciptakan dan menstabilkan unsur baru di luar unsur ke-118.
Pengertian Sistem Periodik Unsur

Sumber: Pexels
Sistem periodik unsur adalah sebuah tabel yang menyusun unsur-unsur kimia berdasarkan kemiripan sifat dan kenaikan nomor atomnya. Tabel ini bukan sekadar daftar, melainkan alat ilmiah penting yang memungkinkan para ilmuwan memahami pola dan hubungan antara berbagai unsur di alam.
Melalui sistem periodik, kita dapat memprediksi sifat fisika dan kimia suatu unsur, mengetahui reaktivitasnya, dan memahami bagaimana unsur tersebut akan berinteraksi dengan unsur lainnya.
Pada sistem periodik modern, unsur disusun secara horizontal ke dalam periode dan secara vertikal ke dalam golongan. Unsur-unsur dalam satu golongan umumnya memiliki jumlah elektron valensi yang sama, sehingga sifat kimianya cenderung mirip.
Sementara unsur dalam satu periode mengalami perubahan sifat secara bertahap dari kiri ke kanan, misalnya dari logam ke non-logam.
Sistem ini juga dibagi ke dalam blok-blok elektron (s, p, d, dan f), yang membantu menjelaskan konfigurasi elektron setiap unsur. Hal ini sangat berguna dalam bidang kimia, fisika, farmasi, teknik, dan ilmu material.
Dengan kata lain, sistem periodik bukan hanya alat bantu belajar, tetapi juga merupakan peta besar bagi para ilmuwan untuk menjelajahi dan memahami dunia unsur, baik yang alami maupun sintetis.
Sistem Periodik Unsur Modern

Sumber: Pexels
Sistem periodik unsur modern adalah bentuk penyempurnaan dari sistem periodik Mendeleev yang kini disusun berdasarkan kenaikan nomor atom (jumlah proton), bukan lagi berdasarkan massa atom relatif.
Penyesuaian ini pertama kali dikembangkan oleh Henry Moseley pada tahun 1913 setelah menemukan bahwa nomor atom merupakan kunci utama dalam menentukan sifat kimia suatu unsur. Dengan susunan ini, sistem periodik modern mampu menjelaskan pola sifat kimia dan fisika unsur-unsur secara lebih akurat dan konsisten.
Dalam sistem ini, unsur-unsur disusun ke dalam baris horizontal yang disebut periode dan kolom vertikal yang disebut golongan. Terdapat 7 periode (periode 1 sampai 7) dan 18 golongan dalam tabel periodik.
Unsur-unsur yang berada dalam satu periode memiliki jumlah kulit elektron yang sama, sedangkan unsur dalam satu golongan memiliki jumlah elektron valensi yang sama, sehingga sifat kimianya cenderung serupa. Misalnya, seluruh unsur di golongan 1A (logam alkali) bersifat reaktif dan mudah membentuk ion positif +1.
Sistem periodik modern juga dikelompokkan berdasarkan blok konfigurasi elektron, yaitu blok s, p, d, dan f.
- Blok s mencakup unsur-unsur di golongan 1 dan 2, serta helium.
- Blok p terdiri dari unsur-unsur di golongan 13 sampai 18.
- Blok d merupakan unsur transisi yang terletak di tengah tabel (golongan 3 sampai 12).
- Blok f terdiri dari lantanida dan aktinida, yang biasanya diletakkan terpisah di bawah tabel utama.
Selain itu, sistem ini juga mengelompokkan unsur berdasarkan jenisnya: logam, metaloid, dan non-logam. Di sebelah kiri dan tengah tabel umumnya merupakan unsur logam, bagian kanan adalah non-logam, sedangkan unsur metaloid terletak di antara keduanya, menunjukkan sifat campuran.
Keunggulan sistem periodik modern adalah kemampuannya untuk:
- Memprediksi sifat unsur baru
- Menjelaskan tren periodik, seperti jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan.
- Mendukung studi kimia lanjutan, seperti reaksi redoks, ikatan kimia, dan struktur molekul.
Perkembangan Terbaru Sistem Periodik Unsur
Dikutip dari wired.com dan berbagai sumber, terdapat perkembangan terbaru pada sistem periodik unsur yang signifikan, yakni:
1. Penambahan Empat Unsur Superberat (Z = 113, 115, 117, 118)
Pada akhir 2015, IUPAC (International Union of Pure and Applied Chemistry) mengesahkan penambahan empat unsur superberat ke tabel periodik, melengkapi periode ke‑7. Unsur‑unsur tersebut adalah nihonium (Nh, Z = 113), moscovium (Mc, Z = 115), tennessine (Ts, Z = 117), dan oganesson (Og, Z = 118)
Nama-nama ini telah melalui proses pengusulan dan konsultasi publik pada periode Juni–November 2016, dan akhirnya resmi diumumkan pada Desember 2016
2. Metode dan Penamaan yang Berarti
Penemuan unsur-unsur ini dilakukan menggunakan akselerator partikel dengan menabrakkan inti-inti ringan, seperti kalsium‑48, ke target logam seperti purenium atau berkelium, dan mendeteksi produk peluruhan radioaktifnya.
Menariknya, penamaan unsur-unur ini mencerminkan asal atau penghormatan:
- Nihonium dari “Nihon” (Jepang),
- Moscovium dari wilayah Moskow (Rusia),
- Tennessine dari Tennessee (Amerika),
- Oganesson untuk menghormati fisikawan Yuri Oganessian
3. Penyelesaian Periode ke‑7 dan Perjalanan Menuju Periode ke‑8
Dengan empat elemen baru tersebut, periode ke‑7 sekarang lengkap hingga Z = 118.
Namun ilmuwan tidak berhenti di situ. Mereka kini sedang berupaya menciptakan unsur Z = 119 dan 120 (seperti unbinilium), meski tantangan teknis sangat besar karena peluruhan yang terlalu cepat.
4. Penelitian Menuju “Island of Stability”
Para peneliti menargetkan apa yang dikenal sebagai island of stability, yang kelompok inti atom superberat dengan waktu paruh lebih panjang dan sifat stabil. Upaya sintetis terbaru untuk unsur 120 dan 116 (livermorium) menggunakan teknik reaksi nuklir canggih menunjukkan potensi kemajuan yang signifikan .
Kesimpulan:
- Usulan dan pengesahan: IUPAC resmi setujui nama dan simbol untuk keempat unsur superberat pada Desember 2016.
- Metode penemuan: Akselerator partikel dan teknik peluruhan nuklir menjadi kunci.
- Tabel periodik: Sudah lengkap hingga periode 7; periode 8 masih dikembangkan.
- Masa depan: Fokus pada pembuatan unsur baru dan pemahaman tentang kestabilan nuklir.
Perkembangan terbaru sistem periodik unsur menunjukkan bahwa ilmu kimia terus mengalami dinamika dan pembaruan seiring kemajuan teknologi dan penemuan ilmiah.
Penambahan unsur-unsur superberat seperti nihonium (Nh), moscovium (Mc), tennessine (Ts), dan oganesson (Og) ke dalam tabel periodik modern menandai babak baru dalam eksplorasi inti atom dan sintesis unsur sintetis.
Perkembangan ini tak hanya memperluas isi sistem periodik, tetapi juga mendorong ilmuwan untuk mengkaji ulang sifat-sifat unsur ekstrem yang belum sepenuhnya dipahami. Dengan dukungan teknologi laboratorium canggih, para peneliti kini dapat memprediksi dan menguji stabilitas unsur baru, mempelajari konfigurasi elektronnya, serta memahami dampaknya terhadap struktur periodik secara keseluruhan.
Grameds, hal ini membuktikan bahwa sistem periodik bukanlah sesuatu yang statis, melainkan dokumen ilmiah hidup yang terus berkembang seiring pengetahuan manusia bertambah.
Manfaat Sistem Periodik Unsur
Sistem periodik unsur bukan hanya sekadar tabel yang sering kita temui di laboratorium kimia. Di balik susunannya yang sistematis, sistem periodik punya beragam manfaat nyata dalam kehidupan sehari-hari. Berikut penjelasan lengkapnya dalam bentuk poin:
1. Mempermudah Identifikasi dan Prediksi Sifat Unsur
Sistem periodik memungkinkan kita mengenali sifat-sifat unsur hanya dengan melihat posisinya dalam tabel. Misalnya, unsur-unsur golongan alkali (seperti natrium dan kalium) bersifat sangat reaktif, sedangkan gas mulia (seperti helium dan argon) sangat stabil.
Manfaat: Hal ini membantu ilmuwan maupun pelajar memprediksi reaksi kimia antar unsur bahkan sebelum dilakukan eksperimen.
2. Dasar dalam Penemuan Unsur Baru
Sistem periodik berperan sebagai peta dalam pencarian unsur baru. Kekosongan yang dulu pernah ada di tabel (seperti sebelum unsur 113–118 ditemukan) memberi petunjuk bahwa masih ada unsur yang belum ditemukan.
Manfaat: Ilmuwan bisa menggunakan pola dan tren periodik untuk memperkirakan sifat unsur yang belum ditemukan dan menciptakannya melalui eksperimen nuklir.
3. Digunakan dalam Industri dan Teknologi
Banyak industri memanfaatkan sistem periodik untuk memilih unsur sesuai kebutuhan produksi. Misalnya, industri elektronik sangat bergantung pada silikon (Si), tembaga (Cu), dan emas (Au).
Manfaat: Pemilihan bahan lebih efisien karena sudah diketahui konduktivitas, titik leleh, dan kestabilan unsur dari tabel periodik.
4. Mempermudah Pengelompokan dan Pengajaran Kimia
Salah satu manfaat paling nyata dari sistem periodik unsur dalam pengajaran kimia masa kini adalah kemampuannya dalam mempermudah proses pengelompokan unsur dan konsep-konsep dasar kimia bagi para pelajar.
Dengan susunan yang logis dan terstruktur berdasarkan kenaikan nomor atom dan kemiripan sifat kimia, tabel periodik menjadi alat visual yang sangat efektif untuk memahami keterkaitan antar unsur.
Di era pendidikan modern, guru dan siswa dapat memanfaatkan sistem ini untuk menjelaskan berbagai topik penting seperti ikatan kimia, konfigurasi elektron, reaktivitas, hingga tren periodik, semuanya dengan cara yang lebih sederhana dan intuitif.
Selain itu, dengan bantuan teknologi seperti simulasi digital dan media interaktif, pembelajaran kimia kini jauh lebih menyenangkan dan mudah dipahami, terutama dalam menjelaskan konsep abstrak. Sistem periodik bukan hanya sekadar alat bantu, tapi juga menjadi jembatan untuk
Manfaat: Membantu siswa mengenali pola, memahami konsep ikatan kimia, energi ionisasi, hingga struktur atom.
5. Penunjang Bidang Medis dan Kesehatan
Beberapa unsur dalam sistem periodik sangat penting dalam dunia medis, seperti yodium (I) untuk kesehatan tiroid, atau radioisotop seperti teknesium-99m untuk diagnosis penyakit lewat radiologi.
Manfaat: Pemanfaatan unsur dalam sistem periodik mendukung diagnosis, terapi, hingga produksi alat medis modern.
6. Kontribusi pada Ilmu Lingkungan
Sistem periodik membantu dalam mendeteksi dan menganalisis pencemaran logam berat di lingkungan, seperti merkuri (Hg) dan timbal (Pb).
Manfaat: Dapat digunakan untuk memantau dan menanggulangi pencemaran serta menjaga kelestarian lingkungan.
7. Mempermudah Riset dan Inovasi Material Baru
Tren dalam sistem periodik seperti elektronegativitas, jari-jari atom, dan afinitas elektron digunakan dalam pengembangan material baru seperti baterai, superkonduktor, dan semikonduktor.
Manfaat: Mendorong inovasi teknologi berkelanjutan yang berdampak langsung pada kehidupan modern.
Kesimpulan
Grameds, sistem periodik unsur adalah hasil dari perjalanan panjang dalam dunia ilmu pengetahuan yang dibangun oleh para ilmuwan dari berbagai zaman. Dari awalnya hanya sekadar daftar unsur sederhana, hingga kini berkembang menjadi sebuah sistem yang sangat terstruktur dan kaya makna.
Tabel ini bukan hanya kumpulan simbol kimia, tapi juga cerminan dari pemahaman mendalam manusia terhadap alam semesta dan susunan materi. Dengan mempelajari sistem periodik, kita tidak hanya memahami sifat unsur-unsur, tapi juga membuka pintu menuju berbagai penemuan di bidang teknologi, kesehatan, lingkungan, dan industri.
Maka dari itu, mari terus memperluas wawasan kita, karena ilmu pengetahuan selalu berkembang. Yuk, lengkapi pemahaman Grameds tentang kimia dan sains lainnya lewat buku-buku terbaik yang bisa kamu temukan di Gramedia.com.